蛋白質が生体内に存在することが明らかになってから、蛋白質の立体構造は不定形なのか、あるいは特定の構造を持つのかといった議論がなされた。1925年に蛋白質の分子量決定が行われ、1928年にウレアーゼの結晶化が行われたことにより、蛋白質が特定の立体構造を持つことが認識されるようになった。この約2年後にはペプシン結晶のX線回折パターンが得られている。X線回折実験による生体高分子の構造研究が脚光を浴びるのは、1953年にDNA二重らせん構造、ミオグロビンとヘモグロビンの低分解能X線結晶構造が発表されてからである。そのような黎明期から約50年を経て、30000以上の蛋白質の立体構造がX線結晶構造解析実験によって明らかにされてきた。蛋白質の立体構造解析は、生命現象の分子・原子のレベルからの理解、蛋白質の構造構築原理の探求といった基礎科学分野に留まることなく、病原蛋白質に対する創薬や蛋白質の工業生産利用などの社会関連分野への波及も期待されている。本研究室では、特異な触媒反応や光化学反応を行なう蛋白質を取り上げて、その構造と機能の関係を探るために生化学、放射光X線を用いたX線結晶構造解析やX線小角散乱実験による研究を行なっている。
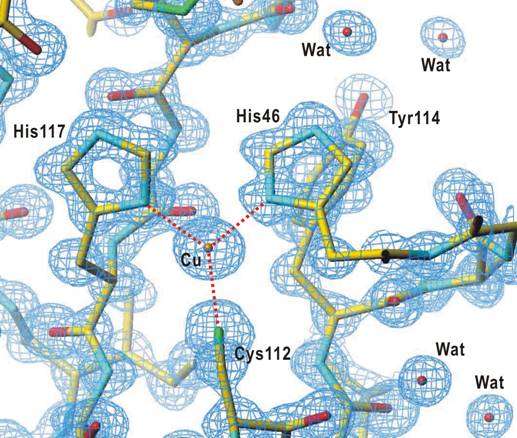
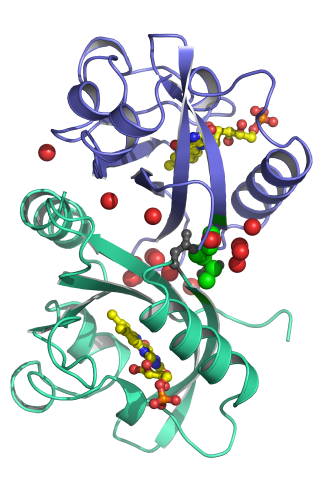
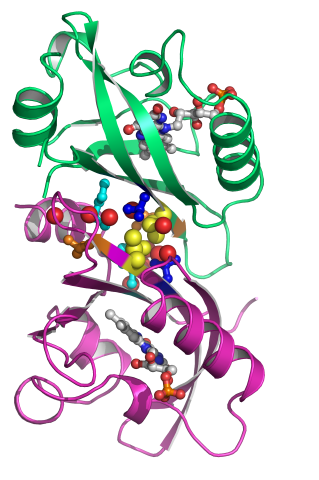
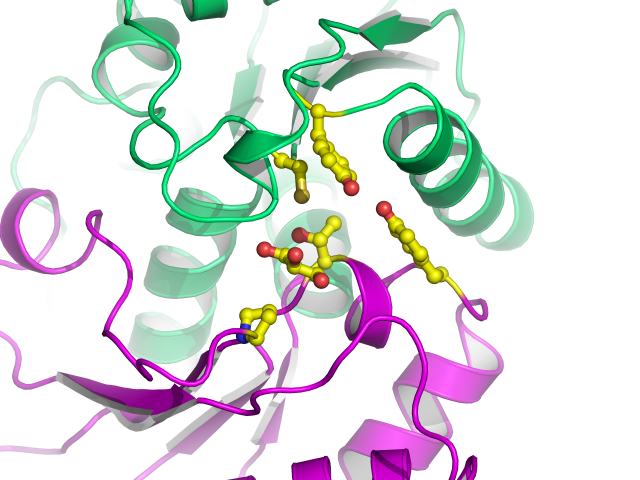
X線結晶解析で得られる電子密度図






↑TOP →HOME

X線結晶解析で得られる電子密度図










↑TOP →HOME